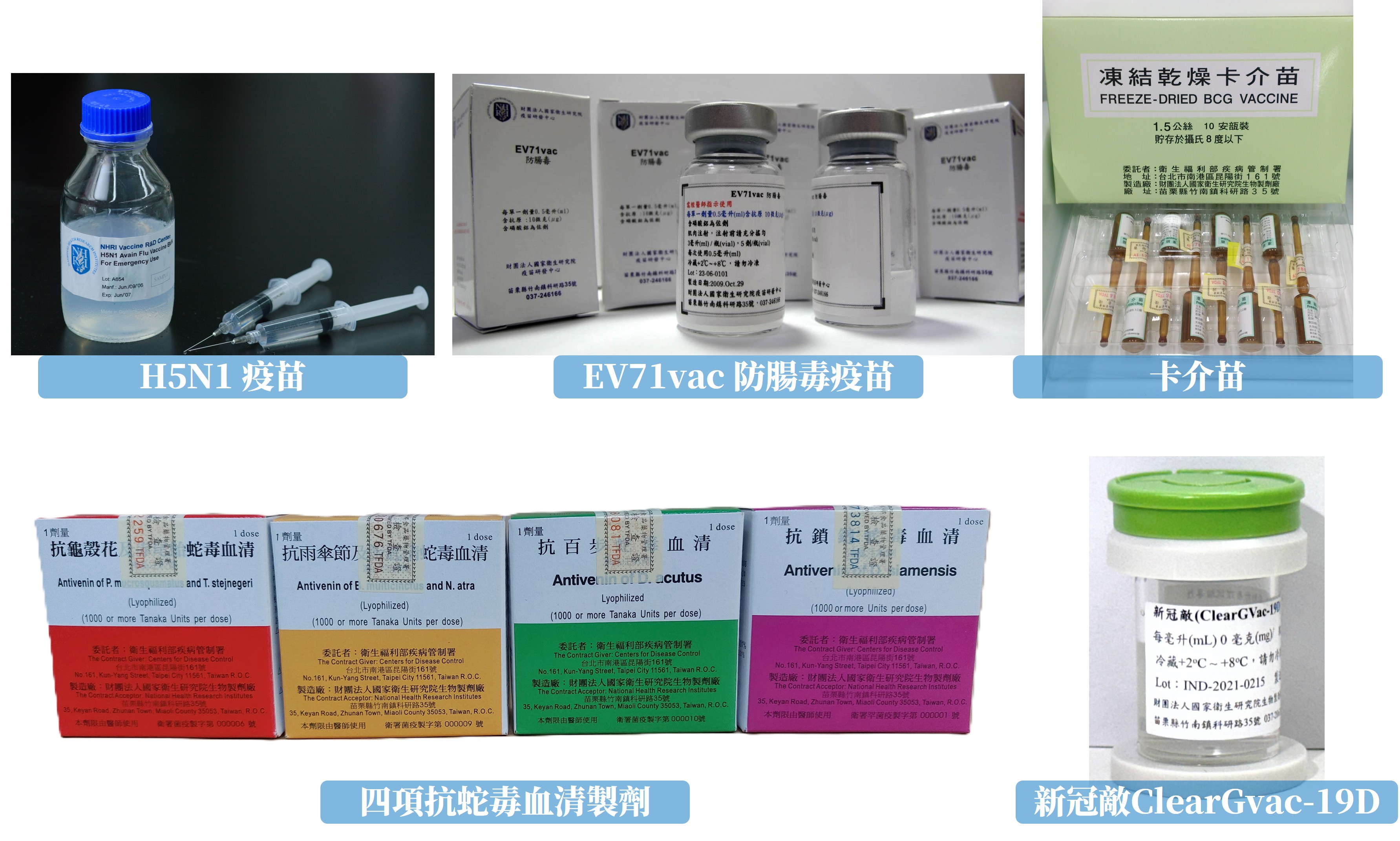
生物製劑廠設置有病毒性疫苗製造區、細菌性疫苗製造區、生物製劑製造區、中央充填區,以及獨立的卡介苗製造區、產程開發實驗室、動物生物安全第三等級實驗室。 目前已具備之製造技術能力說明如下:
(1) 病毒性疫苗
病毒性疫苗之開發,所使用的病毒株/疫苗株皆須經過篩選、馴化培養及動物免疫性測試檢測。生產病毒性疫苗所需之病毒株/疫苗株與細胞株必須遵循種批系統(seed-lot system)之規範以確保疫苗製程與品質之一致性。因此,在確認病毒候選株的特性、抗原性與安全性後必須建立病毒種庫與工作庫(master virus seed and working virus seed),以及適合該病毒繁殖用之細胞種庫與工作庫(master cell bank and working cell bank)。細胞培養之病毒性疫苗生產製程初期需大量培養細胞。當細胞擴增至足夠數量後便以一定之感染劑量(multiplicity of infection, MOI)接種病毒,當細胞病變作用(cytopathic effect, CPE)達90%以上時即可回收病毒液,接續以微過濾、離心或液相層析方法等不同製程組合來純化病毒,並於製程中進行宿主DNA移除、病毒去活化與無菌過濾步驟之後即為疫苗原液(vaccine bulk)。目前生物製劑廠製造區具備一P2等級實驗室可用以建立病毒種庫與工作庫。在上游製程方面設置有細胞轉瓶培養系統、50公升與產製級200公升一次性使用生物微載體反應器(Single-Use Bioreactor, SUB);下游製程則配備有超高速蔗糖梯度連續式離心機(zonal continuous centrifuge)與AKTA系列量產級液相層析(liquid chromatography)純化系統。為保證品質與產品安全性,疫苗產製之場所與過程皆須符合PIC/s GMP與TFDA等規範要求,生產流程必須依照標準作業程序(Standard operating procedure, SOP)與批次製造管制書(batch production record, BPR)執行,此外,對製程各階段也須進行不同的檢測與監控。批次產製之疫苗原液經與佐劑以特定比例調劑,並通過製程品管(in-process QC)檢驗後會送至中央充填區進行充填、密封、貼標及包裝。包裝好之成品將被隔離置放於指定之倉庫冷藏室,由品管單位進行最終產品檢測並放行後,最後由衛生福利部食品藥物管理署(食藥署,TFDA)進行封緘作業。
(2) 細菌性疫苗
細菌性疫苗的生產首要建立細菌庫,並保存於-20℃以下。於生產初期階段,解凍冷凍小管工作細胞庫,接種於有培養基的搖動瓶內進行培養。將所需的菌種數量(OD值)達到擴增所需數量後,再注進盛有培養基的醱酵槽做大量繁殖。開始是毫升(mL)等級的小量培養,然後接種到30公升(L)的試量產級醱酵槽,直到菌種數量達到批量生產的需求。隨之通過微過濾或離心分離或菌體破碎,進行菌體或菌液回收。純化精製過程包括:層析、切向流透析交換介質、切向流濃縮、儲存等。細菌性疫苗最終階段為調劑,主要步驟為添加緩衝液、稀釋及無菌過濾等。冷藏批量細菌性疫苗,經品質管制單位檢定,通過檢測符合品質標準之產品,將被送到中央充填區進行充填,並進行最終產品標貼及包裝。同樣地,包裝好的產品將被隔離冷藏在指定的倉庫區域內,由品質管制單位進行最終產品檢測,最後由食品藥物管理署(TFDA)進行封緘作業。
(3) 卡介苗(BCG)
本廠設置符合PIC/s GMP規範之卡介苗製造區,卡介苗生產在一個獨立實體隔離的製造場域內進行,具有專用的HVAC系統,並包括專屬充填、凍乾及熔封系統,生產過程中的清洗及滅菌都是在該製造區潔淨室內進行。生產卡介苗首先要將卡介苗工作菌種接種到裝有梭氏培養基的特殊培養管中,並於恒溫培養箱進行培養。卡介苗會於培養基的表面形成一層菌膜,透過抽氣過濾收集菌膜。收集好的半乾菌塊經稱重、研磨、稀釋等步驗後以分光光度計進行濃度(OD值)檢測,調整至適當濃度後即可進行充填。現行作業卡介苗是以人工操作方式充填,充填後裝有卡介苗的安瓿瓶(Ampoule)經凍結乾燥程序將水份去除,然後再經真空高溫熔封將瓶口密封。密封好的卡介苗成品送至包裝區進行標貼及最終包裝。包裝好的產品再送到冷藏庫內貯存,由品質管制單位進行最終產品檢測,最後由食品藥物管理署(TFDA)進行封緘作業。
(4) 生物製劑(抗蛇毒血清)
將抗蛇毒血漿原液以注射用水進行稀釋,並加入胃蛋白酶調整pH值後進行消化分解,加入硫酸銨鹽進行第一次沉澱和過濾。收集濾液後,第二次加入硫酸銨鹽進行第二次沉澱和過濾。收集沉澱物,將沉澱物以滅菌濾紙包覆,加壓壓乾沉澱物,以氯化鈉溶液回溶入沉澱物,再以切向流濃縮過系統進行透析,將液體中的硫酸銨鹽置換為氯化鈉溶液,透析後的溶液加入硫柳汞和甘氨酸並調整pH值,完成抗血清原液的調製,再進行無菌過濾得到抗蛇毒血清原液。抗蛇毒血清原液經品質管制單位檢定,通過檢測符合品質標準及中和效價檢測之產品,將被送到中央充填區進行充填,於凍乾、密封後送到包裝區進行最終產品標貼及包裝。包裝好的產品將被隔離冷藏在指定的倉庫區域內,由品質管制單位進行最終產品檢測,最後由食品藥物管理署(TFDA)進行封緘作業。
(5) 生物製劑(其他抗血清產品)
運用製造區場所與設備,生產基因重組蛋白質製劑,基因重組蛋白質經過離心分離、微過濾(MF)、超過濾(UF)、層析及無菌過濾(sterilizing filtration),進行純化以提取所期望的基因重組蛋白質。基因重組蛋白質產品的調劑步驟為吸附、稀釋及無菌過濾等。冷藏批次重組基因蛋白質產品,經品質管制單位檢定,通過檢測符合品質標準之產品,將被送到中央充填區進行充填,於凍乾、密封後送到包裝區進行最終產品標貼及包裝。同樣地,包裝好的產品將被隔離冷藏在指定的倉庫區域內,由品質管制單位進行最終產品檢測,最後由食品藥物管理署(TFDA)進行封緘作業。
(6) 疫苗/生物製劑的產程開發
疫苗、生物製劑的產程開發,是從開發標的的確認,經過轉譯開發到試量產、量產,最後走到臨床試驗的過程。產程開發扮演研發與商品化的樞紐,透過製程開發、工程試運轉、GMP生產、品管監控及法規、品質保證及臨床試驗規劃等各專業的緊密合作,推動新穎疫苗或生物製劑走向商品化。並利用藥物品質源於設計及實驗設計的概念,提升產品品質、生產效率及節約製造成本。
生物製劑廠目前已建立強大的疫苗/生物製劑開發能量,有下游蛋白質、DNA質體、mRNA純化等優良的純化技術,具備執行LNP的包覆技術,並具半製品/成品檢驗分析開發的能量,核心設施亦可提供質譜分析服務,及胜肽和特殊修飾胜肽的合成服務。
有關核酸疫苗開發
隨著新冠疫情的爆發,核酸疫苗的研究與開發迅速成為全球公共衛生的重要議題。核酸疫苗主要包括信使核糖核酸(mRNA)疫苗和去氧核糖核酸(DNA)疫苗,這兩種技術因其快速的開發速度和良好的安全性而受到廣泛關注。核酸疫苗的基本原理是將病原體的基因資訊轉化為抗原,促使人體免疫系統產生針對特定病原體的免疫反應,這種方式不僅能快速生成疫苗,還能針對各種變異株進行靈活調整。
本生物製劑廠致力於建立核酸疫苗符合良好製造規範(Good Manufacturing Practice, GMP)生產技術,並承接政府防疫與保健政策相關外接計畫。目前GMP先導等級的DNA 疫苗生產製程已建立完成,成功生產出全台第一個能預防新冠病毒的DNA疫苗(新冠敵),除了獲國家藥物科技研究發展獎肯定,於民國112年7月通過主管機關核准進行人體新藥試驗,為高效能緊急疫苗平台的建置奠定基礎。
目前本研究團隊持續建立針對新冠病毒的 mRNA-LNP 疫苗生產流程,並完成GMP等級細胞庫生產及相關製程的開發,包含DNA質體線性化、DNA質體純化、mRNA體外轉錄及脂質奈米顆粒(Lipid Nanoparticle, LNP)包覆等製程,完成參數優化與擴大量產測試,初步在動物試驗中證明了mRNA-LNP 疫苗的有效性與良好安全性。
相關成果不僅顯示出本疫苗廠對核酸疫苗的技術成熟度,還展現了在防疫與公衛策略中的重要價值,為未來疫苗產業化與公共健康防護提供堅實保障。